1 октября 2000 года
Отчёт
МЦНМО
МОСКВА 2001
После номера задачи в скобках указано, каким классам эта задача рекомендуется. Вам предлагается решить четыре из предложенных задач по собственному выбору (желательно решать задачи, предназначенные для Вашего или более старшего класса).
1. (8) При пропускании смеси хлористого водорода и бромистого водорода через воду был получен раствор, содержащий равные массовые доли соляной и бромоводородной кислот. Каково было объёмное соотношение газов в исходной смеси?
2. (8-9) Образец известняка (карбоната кальция) прокаливали с целью получения негашеной извести до тех пор, пока его масса не перестала изменяться. Оказалось, что масса образца уменьшилась на 22%. Определите содержание пустой породы в известняке.
3. (8-10) После пропускания диоксида углерода через раствор, содержащий 3,7 г гидроксида кальция, было получено 4 г осадка. Определите массу поглотившегося CO2.
4. (8-10) Один из самых знаменитых опытов в истории
химии состоял в следующем. Шведский помощник аптекаря Карл Шееле внёс кусок
горящего фосфора в колбу, наполненную воздухом, и закрыл её пробкой. По
окончании горения и охлаждении колбы он поместил её горлышком вниз в сосуд
с водой и открыл пробку. Вода поднялась в колбу, заполнив её на 1/5 объёма.
Так Шееле узнал, что воздух, считавшийся ранее простым веществом, состоит
из двух основных компонентов - кислорода и азота. Что изменилось бы в
наблюдениях Шееле, если бы вместо фосфора он использовал:
а) серу;
б) магний;
в) раскалённый уголь?
Ответ поясните уравнениями соответствующих реакций.
5. (9-11) Приведите уравнения реакций, позволяющие осуществить данные цепочки превращений; укажите условия их протекания. Расшифруйте вещества А, Б, Г, Д (предложите возможные варианты).
N2 --> A --> NH3 --> Б --> N2O --> N2
Fe --> FeCl2 --> Г --> Fe(OH)3 --> Д --> Fe(NO3)3 --> Fe2O3
6. (9-11) В вашем распоряжении имеется хлор, сера, нитрат серебра и вода. Получите как можно больше (но не более 20 !) новых веществ, используя эти вещества и продукты их превращений, а также любое лабораторное оборудование.
7. (10-11) В технологии производства меди существуют термины "катодная медь" и "анодная медь". Каково происхождение этих терминов? Запишите необходимые для пояснения ответа уравнения реакций. Какая из разновидностей меди, катодная или анодная, дороже и почему?
8. (10-11) Предельный углеводород имеет единственное монохлорпроизводное и два изомерных дихлорпроизводных. Приведите возможные структурные формулы этого углеводорода.
9. (10-11) При хлорировании изобутана хлором на свету получили изобутилхлорид и третичный хлористый бутил в отношении 2:1. Какие продукты и в каком соотношении получатся при хлорировании 2,3-диметилбутана при тех же условиях? Напишите по одной реакции, характеризующей химические свойства каждого из полученных изомеров.
10. (9-11) Какие из указанных ниже веществ (в виде водных растворов) или их смеси пригодны для растворения металлической меди:
HCl, H2SO4, HNO3, FeCl3, H2O2, ZnCl2 ?
Напишите уравнения соответствующих реакций и уравняйте их методом электронного или электронно-ионного баланса. В тех случаях, когда реакция не идёт, объясните, почему.
Задачи и решения для конкурса по химии подготовлены С. Е. Семёновым, директором Химического лицея N 1033 г. Москвы, и З. П. Свитанько.
1. Согласно закону Авогадро, объёмное соотношение газов равно их молярному соотношению. То есть на каждую молекулу (HCl или HBr) в газе приходится один и тот же объём (поэтому объёмное отношение газов в смеси равно отношению количеств молекул этих газов). Молярные массы M(HCl) = 36,5 г/моль, M(HBr) = 81 г/моль. По условию в водном растворе (а, следовательно, и пропущенной через воду смеси газов) содержится равные по массе количества HCl и HBr, поэтому отношение количеств молекул этих веществ равно отношению масс их молекул, что, разумеется, равно отношению их молярных масс 81/36,5=2,22 Молекулы HCl легче, поэтому их больше (в 2,22 раза).
2.
CaCO3 = CaO + CO2 - уравнение реакции;
CaCO3 - карбонат кальция (известняк)
CaO - оксид кальция (негашеная известь).
Молярная масса карбоната кальция Mr(CaCO3) = 100 г/моль, оксида кальция Mr(CaO) = 56 г/моль. При прокаливании масса образца должна уменьшиться на 44% (((100 г/моль-56 г/моль)/(100 г/моль))*100% = 44%). Реально она уменьшилась на 22%. Значит содержание пустой породы (в данном случае, примесей, которые не разлагаются при нагревании) составляет 22/44 = 0,5 (50%).
3. При пропускании диоксида углерода в раствор гидроксида кальция происходят следующие реакции.
Ca(OH)2 + CO2 = CaCO3 + H2O (1)
выпадение осадка и при избытке CO2 (когда весь гидроксид кальция израсходовался) осадок растворяется
CaCO3 + CO2 + H2O = Ca(HCO3)2 (2)
(так как гидрокарбонат кальция растворим)
При решении нужно рассматривать два случая.
1) Гидроксид кальция находится в избытке - ведём расчёт по карбонату кальция. 4 г CaCO3 составляют 4/100 = 0,04 моль. Количество CO2 также 0,04 моль, что составляет 0,04*44 = 1,76 г.
2) В избытке углекислый газ. Тогда гидроксид кальция полностью израсходовался. Его количество 3,7/74 = 0,05 моль. На его осаждение требуется 0,05 моль CO2. При этом должно выпасть 0,05 моль осадка CaCO3, что составляет 0,05*100 = 5 г.
Поскольку фактически было получено 4 г осадка, то 1 г
осадка растворился по реакции (2).
На это потребовалось
(1/100)*1 = 0,01 моль CO2.
Общее количество углекислого газа 0,05 + 0,01 = 0,06 моль,
что равно 0,06*44 = 2,64 г.
1) В случае углерода следует рассматривать два фактора. Во-первых, CO2, который получается при сжигании углерода - газ, в отличие от оксидов фосфора. То есть он занимает место, которое занимал кислород и которое в случае фосфора сразу заполнилось водой. Второй фактор - это значительная растворимость CO2 в воде, вследствие чего вода всё-таки поднимется в колбу, но меньше, чем на 1/5.
2) Магний реагирует не только с кислородом, но и с азотом, поэтому теоретически вода может заполнить колбу целиком. Однако на практике этого не произойдёт, так как для этого требуется, чтобы в результате сгорания магния в колбе был создан вакуум, что маловероятно. Во всяком случае, колба будет заполнена более чем на 1/5.
3) В случае серы ситуация аналогична углероду, однако SO2 растворим меньше, чем CO2, поэтому воды в колбе будет ещё меньше.
N2 --> A --> NH3 --> Б --> N2O --> N2
Fe --> FeCl2 --> Г --> Fe(OH)3 --> Д --> Fe(NO3)3 --> Fe2O3
Один из возможных вариантов выглядит так.
N2 + 6Li = 2Li3N
Li3N + H2O = LiOH + NH3
NH3 + HNO3 = NH4NO3
NH4NO3 = N2O + 2H2O
2N2O = 2N2 + O2 (при высоких температурах)
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
FeCl3 + 3AgNO3 = 3AgCl + Fe(NO3)3
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2 (термическое разложение)
6.
Здесь возможно множество реакций.
Ниже приведены только некоторые из них для примера.
2AgNO3 = 2Ag + 2NO2 + O2 (терм. разложение)
2H2O = O2 + 2H2 (электролиз)
S + O2 = SO2
SO2 + NO2 = SO3 + NO
SO3 + H2O = H2SO4
H2 + Cl2 = 2HCl (на свету)
AgNO3 + HCl = AgCl + HNO3
3NO2 + 2H2O = 2HNO3 + NO
SO2 + Cl2 = SO2Cl2 и т. д.
7.
В процессе производства меди используется процедура её
электрохимического рафинирования
на аноде Cu - 2e- = Cu2+
на катоде Cu2+ + 2e- = Cu
Неочищенный металл, используемый в качестве растворимого анода, называют анодной медью; чистую электролитическую медь - катодной медью. С точки зрения дополнительных затрат на электроэнергию при получении катодная медь дороже анодной, в которой (и в так называемом анодном шламе) максимально сконцентрированы примеси, присутствовавшие в исходной черновой (металлургической) меди. Однако эти примеси могут оказаться весьма ценными, если они содержат благородные металлы, которые часто сопутствуют меди в её месторождениях, например, серебро или золото. В этом случае ценность анодной меди способна превысить стоимость катодной в расчёте на единицу массы.
8.
8. Примеры таких веществ:
этан CH3СH3;
неопентан (2,2-диметилпропан)

Все атомы водорода группы CH3 можно считать эквивалентными (на самом деле они постоянно меняются местами - CH3-группа "крутится"). Это утверждение может оказаться не совсем верным в случае, если окружение CH3-группы сильно асимметрично, но в нашем случае как раз всё в порядке: у этана, очевидно, обе CH3-группы лежат на оси симметрии молекулы и являются эквивалентными друг другу. Поэтому все атомы водорода также эквивалентны и хлором можно заместить любой из них - в результате получится одна и та же молекула.
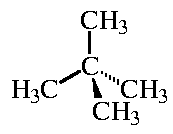
Молекула 2,2-диметилпропана имеет тетраэдрическую форму (в центре воображаемого тетраэдра находится атом углерода, в вершинах - метильные группы -CH3; см. структурную схему). Все метильные группы в этой молекуле также эквивалентны и поэтому монохлорпроизводное у этой молекулы также единственно.
У этана может быть два изомера дихлорпроизводных - 2 атома хлора могут замещать атомы водорода одной или разных метильных групп. Также обстоит дело и с 2,2-диметилпропаном - так как по отношению к одной выбранной вершине правильного тетраэдра 3 остальные эквивалентны, поэтому 2 атома хлора можно разместить по двум разным метильным группам единственным способом.
9. При хлорировании 2,3-диметилбутана
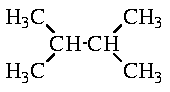
может быть получено два продукта - в результате замещения соответственно третичного и первичного атомов водорода:
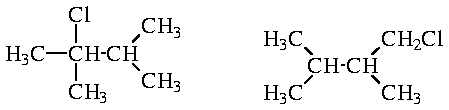
Такая же ситуация наблюдается в случае изобутана. При этом изобутан содержит один третичный и девять первичных атомов H. Если бы скорость замещения по этим двум положениям была одинаковой, то соотношение продуктов реакции было бы 9 : 1. Так как реальное соотношение 2 : 1, скорость замещения третичного атома водорода в 4,5 раз выше скорости замещения первичного атома.
В случае 2,3-диметилбутана имеется 2 третичных атома и 12 первичных атомов водорода, соотношение 6 : 1. Так как третичные атомы замещаются в 4,5 раз быстрее, то соотношение продуктов будет (6*1) : (1*4,5) = 4 : 3.
Химические свойства полученных изомеров различаются. При взаимодействии с раствором щёлочи 1-хлор-2,3-диметилбутан превращается в соответствующий спирт,
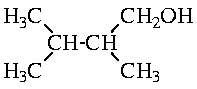
а в случае третичного хлорида основным продуктом реакции будет продукт отщепления, алкен
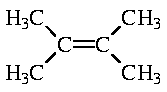
(расположение двойной связи - в соответствии с правилом Зайцева)
1) Растворы HCl, H2SO4 (разбавленная) и ZnCl2 не растворяют медь (так как медь стоит в ряду напряжений правее водорода, а также правее цинка).
2) концентрированная H2SO4 реагирует с медью
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
3) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
(или реакция с образованием NO)
4) Cu + 2FeCl3 = CuCl2 + 2FeCl2
5) Cu + 2HCl + H2O2 = CuCl2 + 2H2O