2. Сначала напомним, что 1 л = 1000 мл.
Маша должна была получить 200+1000=1200 мл раствора, содержащего 200×0,07(7%)=14 г CH3COOH (химическая формула уксуса), но вместо этого она получила тот же объём, содержащий 200×0,7(70%)=140 г уксуса. Понятно, что десятая часть этого раствора (120 мл) содержит необходимые 14 г уксуса. Осталось для получения необходимого объёма добавить 1200-120=1080 мл воды.
Многие школьники предлагали разбавить весь полученный раствор в десять раз. Остаётся только удивляться, что бы делали Маша и её мама с 12 л маринада.
Несколько слов о точности наших измерений: если добавить к 120 мл полученного раствора не 1080 мл, а литр воды, то ничего не случится: маринад будет чуть более крепким [9 Концентрация возрастёт примерно на 4% по сравнению с тем, что получится, если отмерить объём воды строго по расчёту.], что не страшно в домашних условиях. Точность приборов, которыми мы пользуемся в быту, невелика, и, отмеривая литр при помощи мерного стакана, мы легко можем ошибиться на 50, или даже 100 мл, тем более, что часть раствора обязательно окажется на полу, улетит в виде брызг.
В лабораторной практике всё обстоит по-другому. Химикам довольно часто приходится решать задачи по разведению тех или иных растворов. Практически во всех лабораторных экспериментах (особенно биохимических) используются небольшие количества веществ, при этом требуется очень высокая точность. Например, аналитические весы позволяют взвешивать с точностью до десятой доли миллиграмма. Многие лабораторные пипетки (самплеры) позволяют набирать микролитры (а особо дорогие и несколько нанолитров) жидкостей. В таких условиях работы на первое место по важности выходит способ обращения с мерными приборами и посудой. Например, в комнате, где проводят взвешивание, стараются поддерживать определённую температуру, а как правильно опустить пипетку с несколькими микролитрами ценной жидкости в пробирку, чтобы наше вещество не размазалось по стенкам и не улетело в виде брызг - целая наука.
3. Для решения этого задания сначала надо было вспомнить про закон постоянства состава. Т. е. количество атомов каждого элемента в правой и левой частях должно быть одинаковым. Так как все коэффициенты реакций даны, эта задача не такая уж сложная.
При помощи простого подсчёта сразу можно было примерно узнать, какие атомы и в каких количествах содержатся в пропущенных молекулах. Затем необходимо было понять что это за реакция (окислительно-восстановительная, обмена, ...) и какие вещества (относящиеся к какому классу) должны быть на месте пропусков.
И, наконец, необходимо правильно написать ответ.
1) Ca(OH)2=CaO+H2O
Многие школьники замечали, что исходное вещество содержит одну формульную единицу Ca и по две O и H, и так и писали CaO2H2 или даже O2CaH2; это прощалось школьникам, которые только начали изучать химию или ещё не изучали её совсем, но старшие должны задумываться, существует ли вещество, которое они пишут.
2) AgNO3+NaCl=AgClосадок+NaNO3
Это очень распространённая качественная реакция на хлорид-ион и ион серебра. Трудности были у тех, кто ещё не знает, что данные вещества состоят из ионов Ag+, Na+, Cl-, NO3-.
3) C2H6O+3O2=2CO2+3H2O
В этом задании необходимо было просто посчитать, сколько атомов углерода и водорода дано в правой и левой части:
| левая | правая | разница |
| 6O | 2C, 7O, 6H | 2C, 6H, O |
Брутто-формуле C2H6O соответствует два вещества: эфир CH3OCH3 и спирт C2H5OH.
4) CO2+C=2CO
Этот пункт похож на предыдущий, так как сразу можно заметить, что неизвестное вещество содержит одну молекулу углерода и две молекулы кислорода. Это реакция восстановления углекислого газа до угарного, она обычно происходит в печах, когда ещё не всё топливо прогорело, а заглушку уже закрыли (перекрыли доступ кислорода), и остался только CO2. Образующийся угарный газ очень опасен, он незаметно для человека угнетает дыхательную функцию. Многие люди, не умевшие правильно топить печь, погибли от этого (угорели).
В решениях часто встречался вариант O2+2C=2CO, здесь школьников подвела обычная невнимательность.
5) Это задание вызвало больши'е трудности. Не все обратили внимание на то, что BaO2 - пероксид и содержит кислород в степени окисления -1. Правильный ответ:
BaO2+CO2+H2O=BaCO3+H2O2.
Многие предлагали BaO2+CO+H2O=BaCO3+H2O.
Прямой подсчёт показывает, что пропущенное исходное вещество может быть CO, который должен бы реагировать с BaO2.
В этом решении содержится две проблемы: CO - некислотообразующий, химически малоактивный оксид и при пропускании через раствор BaO2 не будет взаимодействовать с ним. Но этого многие школьники могли ещё не знать или не помнить, тем более, что реакция и электронный баланс формально правильные.
| C+2-2e- --> C+4 | | *1 | - восстановитель |
| O-1+e- --> O-2 | | *2 | - окислитель |
Вторая проблема, и её мог заметить любой, состоит в том, что пропущенный продукт - вода, и она, видимо, не участвует в процессе; зачем же её тогда вообще написали в реакции?
Заметим, что если какое-то вещество необходимо в реакции, но при этом не расходуется (это относится в основном к катализаторам и растворителям), то его не указывают одновременно в правой и левой части, а помещают над стрелкой, как условия реакции. Кстати, в скобках рядом с веществом обычно пишут концентрированное вещество или разбавленное, измельченное или суспензия, а агрегатное состояние указывают как нижний индекс. Например:
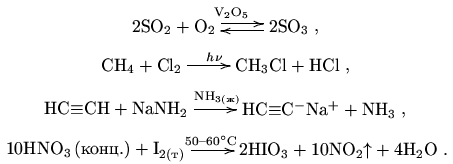
В химической литературе можно встретить совершенно разнообразные обозначения и жесткое правило существует только одно: необходимо записывать уравнения и схемы реакций так, чтобы запись мог легко понять любой грамотный химик.
Вернёмся к нашей реакции. При добавлении CO2 к раствору BaO2, равновесие [10 Это равновесие имеет место при взаимодействии пероксида бария и холодной воды, в тёплой воде (50-60 oC) этот процесс легко идёт в сторону образования перекиси.] BaO2+H2O <=> H2O2+BaO, а точнее
BaO2+2H2O <=> H2O2+Ba(OH)2
будет смещено в сторону продукта, так как BaO будет взаимодействовать
с CO2 и удаляться из зоны реакции в виде нерастворимого карбоната.
6) 2FeCl3+2KI=I2+2FeCl2+2KCl
Для решения этой задачи было необходимо сначала подумать, к какому типу относится эта реакция. Так как в продукты реакции входит иод в степени окисления 0, можно сразу предположить, что это окислительно-восстановительная реакция, потому что реакции, в которых I0 не меняет степень окисления (кроме образования синего комплекса иода с крахмалом) очень редки и их рассматривать в данном случае не стоит.
На следующем этапе постараемся найти элемент, который мог бы окислить или восстановить иод (критерием будет служить электроотрицательность). Рассмотрим все варианты:
K. Теоретически металлический калий подходит на роль восстановителя I+. Но в такой реакции практически невозможно получить I2 , потому что она будет проходить сразу с образованием I-.
Cl. Хлор может подойти на роль окислителя (если в правую часть входит в нулевой или положительной степени окисления), но так как хлор (тем более хлораты) - очень сильный окислитель, в продуктах не может образоваться Fe2+, поскольку железо будет окисляться в первую очередь и до Fe3+, а иод почти наверняка перейдёт в положительную степень окисления.
Fe. Железо может быть как окислителем, так и восстановителем, поскольку в правую часть уравнения входит в промежуточной степени окисления. Но в данной реакции металлическое железо не может восстанавливать иод до молекулярного иода из-за того, что I+ недостаточно сильный окислитель. А вот вариант восстановления железа +3 иодом -1 подходит очень хорошо, так как Fe3+ достаточно мягкий окислитель, чтобы получился I2.
Для того, чтобы правильно написать исходные соединения, напишем электронный баланс, подсчитав имеющиеся у нас атомы, поскольку в качестве подсказки нам даны все коэффициенты реакции:
| Fe+3+e- --> Fe+2 | | *1 | - окислитель | |
| *2 | |||
| I-1-e- --> I0 | | *1 | - восстановитель |
Из имеющегося набора катионов и анионов (2Fe+3, 2I-, 2K+, 6Cl-) можно "составить" только 2Fe+3Cl3 и 2KI. (На 2Fe+3I3 просто "не хватит" иода.)
7) Mg3N2+8HCl=3MgCl2+2NH4Cl
Это не совсем обычная реакция обмена. Исходное вещество - динитрид тримагния. Это жёлто-зелёное кристаллическое вещество. Кроме водорода N3- образует соединения с щелочными и щёлочноземельными металлами. Эти соединения высоко реакционноспособны, из них относительно устойчивы только нитриды лития и магния благодаря тому, что их ионные радиусы не сильно отличаются от ионного радиуса азота. Нитрид лития получается при обычных условиях при взаимодействии металлического лития и азота. Для получения нитрида магния необходимо нагревание. Отметим, что в жидком аммиаке эти соединения ведут себя подобно оксидам в воде (в данном случае азот аналогичен кислороду). Но всё равно они легко разлагаются при действии различных реагентов (кислот, воды и т. д.) на аммиак (соль аммония) и соответствующую соль металла.
8) NO2+SO2=NO+SO3
В этом задании надо заметить, что второй неизвестный продукт должен содержать серу и кислород. Нам известны следующие кислородосодержащие соединения серы [11 Мы рассматриваем только соединения с одним атомом серы, а вообще сера способна образовывать довольно длинные цепочки из своих атомов, благодаря этому разнообразие соединений серы очень велико (см. задание 6).]: H2SO3, H2SO4 и SO3.
Сернистая кислота не подходит, так как в этом случае должна была произойти реакция перехода молекулы воды от соединения вида NO*H2O к SO2, но NO некислотообразующий оксид, т. е. не может присоединять воду с образованием кислоты.
В случае H2SO4 и SO3 имеет место окислительно-восстановительная реакция. Сера отдает два электрона, а так как у нас только один азот, то его атом их и принимает:
| S+4-2e- --> S+6 | | *1 | - восстановитель |
| N+4+2e- --> N+2 | | *1 | - окислитель |
Значит, исходный продукт - NO2. Вариант с гидроксидом (образование H2SO4) невозможен, так как NO2 - тоже некислотообразующий оксид.
9) CrCl2+3Na2S+6H2O=2Cr(OH)3+6NaCl+3H2S
Это простая реакция обмена. Запишем уравнение с пропусками в полном ионном виде: 2Cr3++6Cl-+3 +6H2O = 2 +6Na++6Cl-+6H++3S-
Как и во всех остальных пунктах этой задачи, внимательно посмотрим, чего не хватает (необходимо вспомнить, что H2O <=> H++OH-):
| левая | правая |
| 6Na+ и 3S- | 2Cr3+ и 6OH- |
Многие писали, что хром переходит в Cr2O3. Из раствора гидроксид хрома осаждается в виде кристаллогидрата Cr(OH)3*nH2O, и затем при долгом стоянии может постепенно терять кристаллизационную воду (это называется "старением" осадка, при этом гидроксид хрома теряет реакционную способность). При сильном нагревании происходит превращение Cr(OH)3 ->to Cr2O3+H2O. Так как мы не находим "лишней" воды в продуктах, то можно сказать, что оксид хрома в данной реакции не образуется.
10) 4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O
В этом пункте у нас только одно пропущенное вещество, поэтому понятно, что оно содержит все те атомы, которые есть в правой части, но которых нет в левой, при этом выполняется закон постоянства состава. Поэтому целесообразно подсчитать, сколько атомов каждого сорта в каждой части, и уравнять. Итак, пусть пропущенное вещество содержит x атомов N, y атомов O, z - H и u - Ca. Тогда:
| 4xN | + | 0N | = | 2N | + | 2N | + | 0N | | x = 1 |
| 4yO | + | 2*2O | = | 2*3O | + | 2*2O | + | 2O | | y = 2 |
| 4zH | + | 2*2H | = | 0H | + | 0H | + | 2*2H | | z = 0 |
| 4uCa | + | 2Ca | = | 1Ca | + | 1Ca | + | 0Ca | | u = 0 |
то есть, пропущенное соединение - NO2.
11) KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
Это реакция сопропорционирования. Реакции такого типа очень характерны для элементов, имеющих несколько устойчивых степеней окисления. Встречаясь в реакционной смеси, атомы одного и того же элемента, имеющие различные степени окисления, стараются "поделить поровну" свои электроны и могут образовывать в зависимости от стехиометрических соотношений и условий одно или несколько промежуточных соединений, например:
H2S + H2SO4(конц.) --> S(осадок) + SO2(газ) + 2H2O ,
H2S + 3H2SO4(конц.) -->(кипение) 4SO2(газ) + 4H2O .
Кроме того, возможна обратная реакция: диспропорционирование. Например, диоксид азота диспропорционирует под действием щёлочи:
2N+4O2 + 2NaOH(разб.) = NaN+3O2 + NaN+5O3 + H2O .
4. Несколько школьников предложили самое правильное решение этой задачи. Они посчитали, что Пете было бы полезнее не химичить дома на кухне, а решать домашние задачи по математике самостоятельно. Организаторы турнира полностью одобряют такую позицию!
Тем не менее, необходимо разобраться с химической стороной этого преступного списывания:
1) Письмо было написано фенолфталеином. Это довольно распространённый индикатор, который в кислой и нейтральной среде бесцветен, а при pH 8,2-9,8 становится малиново-красным (интервал индикаторного перехода [12 pH=-lg[H+], так обычно выражают концентрацию ионов водорода - показатель кислотности раствора. Или, если сказать по-другому, pH=x означает, что концентрация ионов H+ в растворе равна 10-x моль/литр. В нейтральной среде pH=7, в кислой среде pH<7, в щелочной, соответственно, pH>7]), это объясняется тем, что в щелочной среде в результате перераспределения электронной плотности в его молекуле образуется хиноидная структура (хромофор), который и придаёт малиновую окраску соединению.
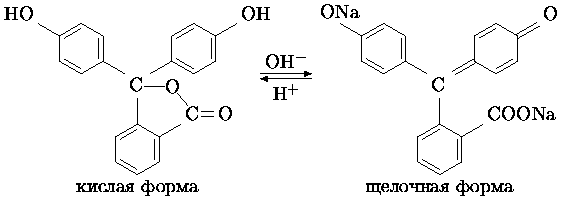
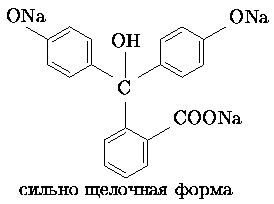
В сильно щелочной среде (pH ~ 13) фенолфталеин теряет свою окраску и становится опять бесцветным.
Для тех, кто ещё не изучал или только начал изучать органическую химию, поясним: в химических формулах "угол" между связями, в котором не указано никакой буквы (а также "развилка", "перекрёсток" и просто конец) условно обозначает, что в этом месте находится атом углерода; если валентность этого атома углерода за счёт всех обозначенных химических связей оказывается равной n<4, то подразумевается, что с этим атомом углерода ещё связано (4-n) атомов водорода. Так поступают только с углеродом и связанным с ним водородом в структурных формулах органических соединений [13 Такое сокращение допустимо, но не обязательно. Обозначение всех атомов C и H не считается ошибкой, однако в большинстве случаев уменьшает "читаемость" формулы и увеличивает необходимую для воспроизведения этой формулы площадь бумаги. Предлагаем вам нарисовать полностью (в процессе изучения химии это всё равно полезно проделать хотя бы один раз) какую-нибудь из приведённых здесь структур фенолфталеина и убедиться в этом самостоятельно.], другие атомы (кислород, азот и т. д.) обозначают обязательно. Обратите внимание на то, что, когда мы пишем формулу неорганического соединения, мы редко указываем его строение, но чётко записываем его состав, в органике же гораздо более важно строение, а точный состав можно определить по валентности.
Когда Петя подержал письмо над чашкой с нашатырным спиртом, листок пропитался пара'ми аммиака. При этом происходит взаимодействие аммиака с водой, сорбированной на волокнах бумаги:
NH3 + H2O --> NH4++OH-.
Среда в толще бумаги становится щелочной, и индикатор меняет окраску.
В решениях, особенно в тех, которые писали младшие школьники, были довольно распространены "пищевые" версии: молоко и лимонный сок. Видимо из-за того, что в художественной литературе эти вещества часто используются для тайнописи. Только непонятно, почему же надпись проявлялась при действии паров аммиака.
2) С этим пунктом проблем практически не возникло, очень многие совершенно справедливо предлагали подержать листок над чашкой с нашатырным спиртом ещё раз, однако полный ответ в этом пункте включал объяснение, почему надпись исчезла, пока Петя бегал за тетрадкой. Дело в том, что аммиак быстро испарился и фенолфталеин вернулся в прежнюю форму.
3) Фенолфталеин меняет свою окраску при действии любого основания. Аммиак плох тем, что летуч. Но практически все остальные основания не обладают этим недостатком. Поэтому, чтобы надпись появилась и больше не исчезала, можно обработать письмо раствором обычной щёлочи, например NaOH.
Но у NaOH и многих других гидроксидов есть свои недостатки - они слишком "едкие" - требуют аккуратного обращения: вызывают химические ожоги при попадании на кожу, слизистые оболочки; попадание в глаза - это серьёзная травма.
Кроме экспериментатора NaOH "разъедает" и обычную бумагу (она "расползается", а после высыхания рассыпается в труху). Поэтому гидроксиды для целей нашей задачи скорее всего не подходит. К тому же они не используются в быту (по тем же вышеописанным причинам). Петя скорее всего не найдёт таких веществ у себя дома.
Щелочную среду могут создавать и другие, в том числе более "бытовые" вещества, например, раствор питьевой (NaHCO3) или стиральной (Na2CO3) соды в воде. Это происходит в результате гидролиза:
Na2CO3(разб.) = 2Na+ + CO32-, CO32- + H2O + OH-
NaHCO3(разб.) = Na+ + HCO3-, HCO3- + H2O + OH-
В результате взаимодействия образовавшихся таким образом в растворе ионов OH- с молекулами фенолфталеина образуется окрашенная форма этих молекул.
Раствор соды нужно наносить аккуратно, чтобы не смыть текст (например, кисточкой, или приложить письмо к смоченному в растворе листу бумаги или куску ткани). Окунуть целиком в раствор соды само письмо - идея не очень хорошая.
При проверке решений как правильные засчитывались любые ответы, в которых предлагалось подействовать на листок нелетучим основанием. Большинство участников турнира, догадавшихся до этого, писали, что листок надо смочить щёлочью, и несмотря на то, что в практическом отношении этот вариант не очень удачен (см. выше), он оценивался полным баллом.
Очень разумными, но, к сожалению, не совсем химическим было предложение нескольких участников обвести надпись ручкой или карандашом, поместить в пакет и даже заламинировать.
Те, кто в первом пункте предлагали в качестве чернил молоко или лимонный сок, здесь предлагали подвергнуть листок термической обработке (прогладить утюгом, подержать над лампой, пламенем плиты...).
Распространённым был вариант обмакнуть письмо в нашатырный спирт. Проблему быстрого испарения аммиака можно этим решить, но надпись смоется, бумага размокнет, и переписать задачу по математике Петя уже не сможет.
5. Ответ: Zn (цинк).
При взаимодействии азотной кислоты с металлами в зависимости от концентрации кислоты и свойств металла могут выделяться NO2, NO, N2O и NH3. При этом в последнем случае газ не будет выделяться, так как с аммиаком будет взаимодействовать азотная кислота (которая, хотя и сильно разбавлена, но имеется в достаточном количестве) с образованием NH4NO3. Запишем реакцию взаимодействия металла [14 Будем считать металл одновалентным. Так как коэффициенты реакции определяет количество электронов, переходящих от одного атома к другому, то в случае двухвалентного металла мы сможем умножить молекулярную массу, которую мы получим, на два, для трёхвалентного - на три. Можете это проверить самостоятельно, написав уравнения реакции с соответствующими коэффициентами и пересчитав молярную массу.] M с разбавленной азотной кислотой:
8M + 10HNO3 = 8MNO3 + NH4NO3 + 3H2O.
Газ, который выделялся при действии щёлочи, - аммиак:
NH4NO3 + KOH = NH3(газ) + KNO3 + H2O.
Из этих двух уравнений реакции видно, что на один моль газа приходится 8 моль металла. Аммиака выделилось 1,12/22,4=0,05 моль, значит металла было 0,4 моль, и молярная масса М, если металл одновалентен, равна 13,0/0,4=32,5 г/моль. Но металл с такой атомной массой в природе не встречается, похожую массу имеет сера (32), но она по понятным причинам не может считаться правильным ответом. Двухвалентный металл должен иметь массу 2*32,5=65 г/моль. Такую атомную массу имеет цинк, и это правильный ответ. Подходящий трёхвалентных металлов (молярная масса 3*32,5=97,5 г/моль) тоже нет.
Тот же ответ можно было получить, не разбирая случаи с валентностью, а воспользовавшись эквивалентами, хотя по своей сути решение осталось бы прежним.
6. Эта задача не предполагает полного решения. Мы приведём лишь некоторые наиболее характерные примеры.
Некоторые простые вещества образуют длинные цепочки ковалентно связанных атомов. Как правило, такие вещества имеют много аллотропных [15 Аллотропия - существование одного и того же химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам, т. н. аллотропических (или аллотропных) модификаций.] модификаций и в соединениях также склонны к образованию полимеров.
Сера. Обычно элементная сера состоит из восьми атомов, которые могут быть по-разному упакованы в кристаллическою решетку. Кроме того, существует неустойчивая пластическая сера - хаотично переплетенные зигзагообразные длинные цепи. В соединениях сера также часто образовывает длинные полимерные цепи, в которых звенья могут соединяться через атомы кислорода или самой серы. Состав и строение таких веществ зависит от условий получения.
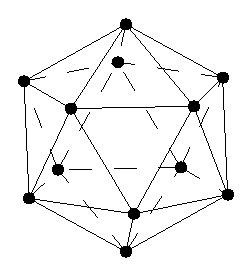
Бор. Имеет более 10 аллотропных модификаций.
Атомы бора в них объединены в группировки B12, имеющие формы
икосаэдра - двадцатигранника.
Гидриды бора (бораны) образуют довольно сложные по структуре соединения с многоцентровыми связями.
Особенно интересные структуры образуют кислородные соединения бора. Это могут быть плоские зигзагообразные цепи, соединённые друг с другом тетраэдры, "соты" и т. д.
Фосфор. Фосфор имеет большое число аллотропных модификаций, из которых важнейшие - белый и красный фосфор. В пара'х он находится в виде четырёхатомной молекулы P4, при конденсации образуется белый фосфор P4, который при длительном хранении или нагревании переходит в полимер - красный фосфор. Ещё одна аллотропная (или аллотропическая) модификация - чёрный фосфор - имеющая структуру, похожую на графит, состоит из гофрированных слоёв. Во всех модификациях фосфор связан с тремя своими соседями. Фосфор может также образовывать цепочки (не очень длинные) и в соединениях с кислородом.
Кремний. Простое вещество, имеет алмазоподобную модификацию. Соединения кремния с кислородом образуют большой класс соединений - оксисиликаты. В основе их лежит структура, изображенная на рисунке.
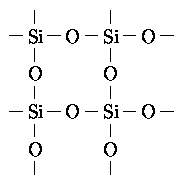
Каждый кислород связан с двумя атомами кремния, а каждый кремний - с четырьмя кислородами. Взаимное пространственное расположение этих атомов может быть очень разным, кроме того, в структуру оксисиликатов входят различные ионы. И все вместе они образуют очень длинные и разветвлённые цепи, сети и пространственные структуры.
Биополимеры. Многие биологически активные вещества имеют вид длинных цепочек. Кроме связей С-С встречаются связи с азотом, например, в белка'х, представляющих из себя длинные последовательности аминокислот, они соединяются между собой пептидной связью.
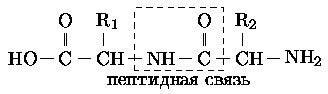
На рисунке изображён дипептид - две аминокислоты, R1 и R2 - радикалы, определяющие биологические (биохимические) свойства аминокислот.
Хотя в организме встречается всего 20 видов (20 различных радикалов) аминокислот [16 В тканях некоторых организмов содержатся и другие (необычные) аминокислоты - см. стр. 73 (вопрос N 7 по биологии).], они образуют очень длинные цепочки, белок может включать до 10 тысяч аминокислот (хотя оговоримся, что они не образуют все одну длинную цепь, как правило это несколько длинных цепочек (от двух до десяти), связанных друг с другом электростатическими взаимодействиями и ковалентно через дисульфидные мостики -S-S-).
Другой пример биологических макромолекул - молекулы, несущие генетическую информацию - ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота), связь между соседними звеньями этих очень длинных цепочек осуществляют фосфат (кислотный остаток фосфорный кислоты) и сахар (дезоксирибоза и рибоза соответственно).
Объём и цели этой книжки не позволяют сколько-нибудь подробно описывать структуру и функции белков и нуклеиновых кислот, а также просто перечислить все биологически активные молекулы, представляющие из себя длинные цепи. Ваше знакомство с ними начнётся в курсе общей биологии. Скажем только, что эти длинные цепи атомов составляют химическую основу всего живого.
Водородная связь. Во всех перечисленных выше примерах образовыванию длинных цепочек служила ковалентная (как полярная, так и неполярная) связь. Другой пример связи - водородная. Водородная связь - это электростатическое взаимодействие водорода, несущего большой положительный заряд, с атомом, несущим большой отрицательный заряд. Например, молекулы воды образуют не просто цепи, а целую решётку из молекул. Конечно, эти связи очень непрочные, но, тем не менее, они оказывают серьёзное влияние на свойства веществ. В этом можно убедится, сравнив температуры кипения воды и сероводорода и других гидридов элементов VI группы - у воды температура кипения аномально высокая.
Обратите внимание, что между молекулами HF очень сильные водородные связи, так как фтор электроотрицательнее водорода, но температура кипения HF гораздо ниже, чем у воды. Это объясняется тем, что молекулы фтороводорода "слипаются", образуя димеры, а не разветвлённые цепи связанных между собой молекул, как H2O.
Для справки приводим температуры кипения названных веществ при атмосферном давлении.
| H2O | 100,00 oC | HF | 19,52 oC |
| H2S | -60,35 oC | HCl | -85,08 oC |
| H2Se | -41,4 oC | HBr | -66,8 oC |
| H2Te | -2 oC | HI | -35,4 oC |
7. Реакцию отщепления галогенводорода с образованием диена называют элиминированием. Известно несколько механизмов этой реакции, мы приведем схему только одного из них.
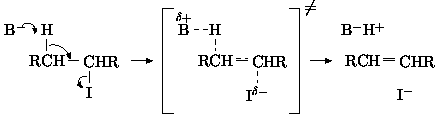
И ещё немного об обозначениях, принятых в химической литературе: обычно B: или B- обозначается основание (от английского basis - основание), в данном случае это OH-, а продукт BH, соответственно, вода. Кислоты условно обозначаются A+ (от acid - кислота). В квадратных скобках со значком =/= обозначают промежуточное соединение, которое в чистом виде не существует, но отражает механизм протекания реакции. d- и d+ означают, соответственно, избыток и недостаток электронной плотности [17 Так как электрон - отрицательно заряженная частица, избыток электронной плотности придаёт атому частичный отрицательный заряд, а недостаток - частичный положительный.], стрелочки - направления её перераспределение.
Так как получается два изомерных алкена, можно предположить, что исходный иодалкан - вторичный [18 Иод связан со вторичным атомом углерода, то есть таким, который имеет ровно две связи углерод-углерод.].
Рассчитаем массу продукта: нам известно, что 7/8 моля продукта весят 49 г, то есть молекулярная масса этого продукта 56 г/моль. Общая брутто-формула всех алкенов CnH2n. Составим простое уравнение: 12n+2n=56, n=4, т. е. получен алкен C4H8. Значит, исходное соединение имело бруттоформулу C4H9I. Простым перебором можно показать, что вторичный изомер с такой формулой всего один: CH3-CHI-CH2-CH3 (если у Вас получилось два, то проверьте, не симметричны ли они).
Интересный вопрос, какой из алкенов был основным продуктом и получился в бо'льшем количестве. В органической химии существует правило Зайцева, по которому водород с большей вероятностью отщепляется от того атома C, с которым до отщепления было связано меньшее количество атомов Н. Это объясняется тем, что в этом случае образуется более устойчивый промежуточный продукт.
Более подробно о химических реакциях, которые соответствуют (или, наоборот, не соответствуют) правилу Зайцева, узнают те из вас, кто будет изучать органическую химию в ВУЗе.
8. Фенол - ядовитое вещество, которое может содержаться в сточных водах промышленных предприятий. Чтобы убедиться, что сточные воды достаточно хорошо очищены, нужно уметь определять в них малые концентрации вредных компонентов, в том числе фенола. Метод, описанный в задаче, основан на реакции фенола с бромом, которая протекает следующим образом:
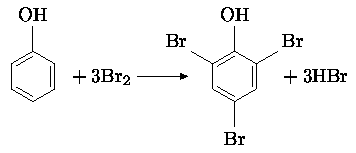
Мы знаем, что бромирование бензола идёт только в присутствии катализатора (например, FeBr3) и при этом только один атом водорода бензольного кольца замещается атомом брома. В случае же фенола реакция протекает очень легко и сразу же даёт трибромпроизводное. Это объясняется активирующим действием гидроксильной группы на бензольное кольцо. Неподелённая пара электронов, принадлежащая атому кислорода, втягивается в кольцо, в результате чего электронная плотность в кольце повышается. Так как реакция бромирования протекает по механизму электрофильного замещения, повышение электронной плотности благоприятно для реакции. При этом можно заметить, что гидроксильная группа активирует не любые положения в бензольном кольце, а именно положения 2, 4 и 6. Вещество 2,4,6-трибромфенол - твёрдое, выпадает в осадок.
Бром, необходимый для бромирования фенола, образуется в реакционной смеси при взаимодействии бромида и бромата калия в кислой среде:
5KBr + KBrO3 + 6HCl = 6KCl + 3Br2 + 3H2O
Избыток брома, оставшийся после связывания всего фенола, взаимодействует с иодидом калия
Br2 + 2KI = I2 + 2KBr
И, наконец, выделяющийся иод титруют раствором тиосульфата натрия. При этом реакция протекает по уравнению:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Соединение Na2S4O6, которое при этом образуется, называется тетратионат натрия. Реакция иода с тиосульфатом натрия часто используется в окислительно-восстановительном титровании, так как она протекает быстро и количественно. Кроме того, конечную точку титрования легко обнаружить, так как иод образует с крахмалом интенсивно окрашенный сине-фиолетовый комплекс. Перед титрованием в раствор добавляют несколько капель раствора крахмала, при этом сразу же появляется сине-фиолетовая окраска, так как раствор содержит иод. По мере прибавления Na2S2O3, иод постепенно расходуется. В тот момент, когда добавленное количество тиосульфата точно эквивалентно количеству иода, реакция проходит полностью (иода не остаётся), и окраска исчезает. Это и есть конечная точка титрования. По количеству раствора Na2S2O3, израсходованного к этому моменту, рассчитывают количество иода, которое получилось в реакции с бромом, а по нему - количество брома, которое осталось после взаимодействия с фенолом. Поскольку мы можем определить исходное количество брома, которое получилось в растворе из бромата и бромида, то теперь по разности можно узнать количество брома, которое пошло на реакцию с фенолом и, наконец, количество фенола. Конечно, нет никакой надобности каждый раз проводить всю эту последовательность расчётов. При разработке методики обычно сразу выводят формулу, по которой искомую величину можно определить непосредственно из количества затраченного реагента, в данном случае концентрация фенола в воде будет сразу определяться при подстановке в формулу количества тиосульфата натрия.
Метод применим к любым фенолам, которые содержат СН-связи, активированные к реакции с галогеном. В самом феноле, как мы видим, - это связи при 2, 4 и 6 атомах углерода. Естественно, в случае замещённых фенолов необходимо знать количество реагирующих СН-связей, чтобы правильно рассчитать массу определяемого фенола. Если все указанные положения заняты другими заместителями, как, например, в 2,4,6-трихлорфеноле, то метод неприменим.
Чтобы метод дал точные результаты, необходимо соблюдать следующие правила: количество бромида в растворе должно быть как минимум в 5 раз больше количества бромата (иначе выделяться будут Cl2 и Br2), соляной кислоты должно быть не очень много, так как тиосульфат натрия нестоек в кислой среде.
Критерии проверки и награждения
Каждая задача оценивалась в баллах; баллы, полученные участником за все задачи на конкурсе по химии, суммировались.
Баллы за решения задач выставлялись следующим образом:
| N задачи\класс | <8 | 9 | 10 | 11 |
| 1 | 4 | 3 | 1 | |
| 2 | 5 | 3 | ||
| 3 (1-я часть; за одну реакцию) | 1 | 0,5 | 0,25 | |
| 3 (2-я часть; за одну реакцию) | 1 | 0,5 | ||
| 4 | 2+1+2=5 | 1+1+1=3 | ||
| 5 | 5 | 4 | ||
| 6 (за каждый вариант) | 2 | 1 | ||
| 7 | 5 | |||
| 8 | 5(реакции) + 3(доп. вопросы) = 8 | |||
(в случае частичного решения задачи оно могло оцениваться меньшим, чем указано в таблице, количеством баллов).
Грамоты "за успешное выступление на конкурсе по химии" и баллы многоборья присуждались в соответствии с суммой баллов по задачам следующим образом:
| Класс | балл многоборья (e) | грамота (v) |
| <7 | 2 | 3 |
| 8 | 3 | 4 |
| 9 | 4 | 5 |
| 10 | 4 | 6 |
| 11 | 4,5 | 6 |